為釋除武漢肺炎威脅,全球正指望疫苗盡快面世。據估計,研發中的疫苗超過 150 種,除了跟時間競賽,國際間的競爭同樣愈趨激烈。中俄兩國未待臨床試驗完成,已有限度授權採用疫苗,與外國商討疫苗供應協議;美國總統杜林普亟待疫苗於 11 月大選前問世,監管部門卻堅持安全底線,近日再有疫苗臨床測試被叫停。究竟哪國研發的疫苗,能夠率先為全球解困?
疫苗由研發、臨床試驗、安全審批、到推出市場,普遍要長達 10 至 15 年時間,歷史上最快的研發紀錄是腮腺炎疫苗,需時亦長達 4 年。對照當下,目前有最少 91 種武肺疫苗處於動物實驗階段,45 種正對人體進行臨床測試,務求最快於明年推出市場,研發進度堪稱史無前例。
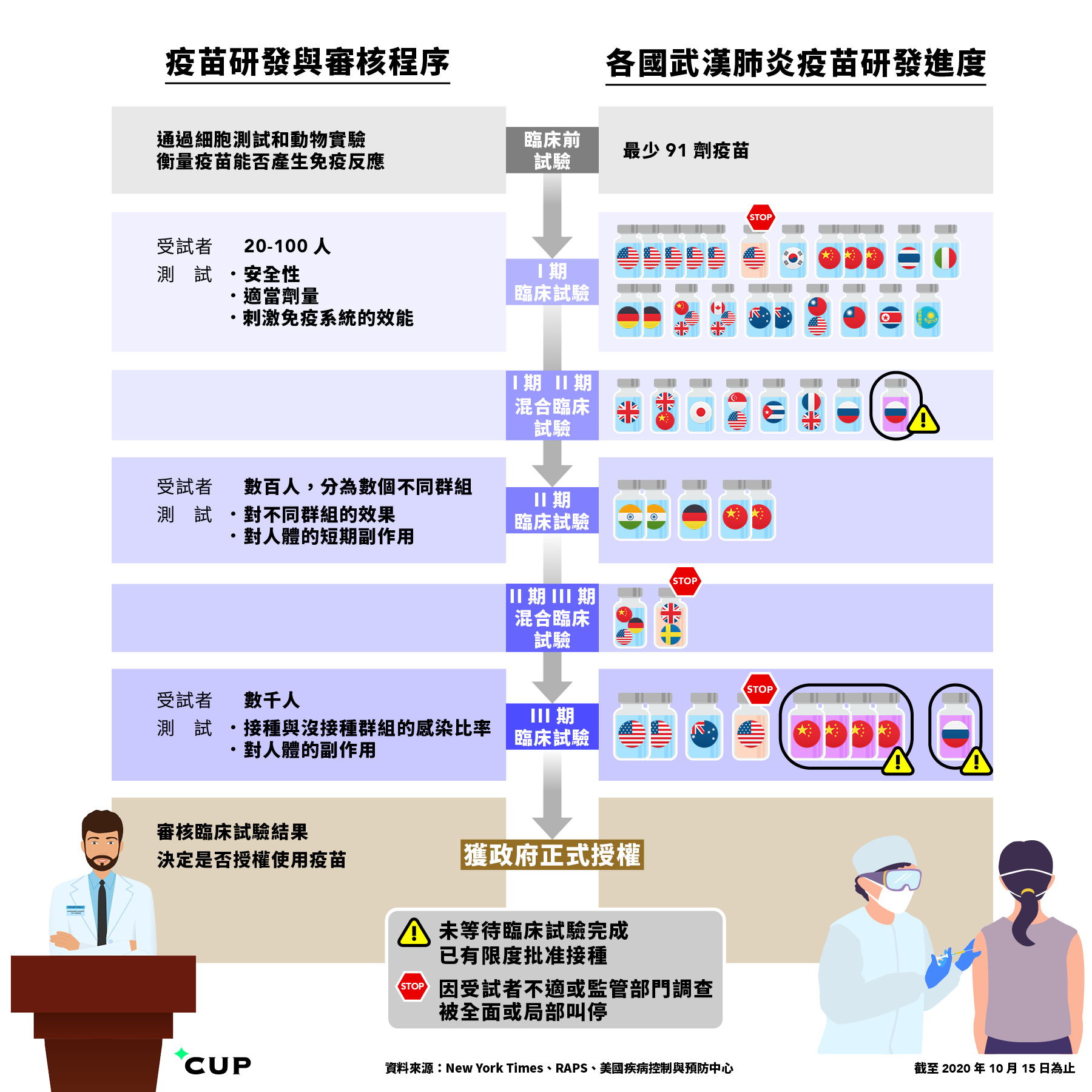
自疫情爆發後,美國已啟動 Operation Warp Speed 計劃,承諾投資 100 億美元以加快研究速度。其他競爭的國家,除了英國、德國、俄羅斯、中國等,甚至有哈薩克和泰國,就連自稱「零感染」的北韓亦加入戰圈,7 月 18 日宣稱新疫苗正進行臨床測試,但沒有對外公佈任何細節。
為加快研發進度,部分疫苗製造商正壓縮臨床驗證程序,混合兩期臨床試驗同時進行。譬如 Ⅰ/Ⅱ 期測試同時執行,意味著首次臨床試驗,受試者已多達數百人,科研人員會透過樣本同時解答兩期試驗的問題。
美國國家過敏和傳染病研究所(NIAID)總監 Anthony Fauci 亦表示,假如試驗中期得出大比數結果,可提早結束測試;杜林普政府還施壓,要求食品藥品監督管理局(FDA)盡快審批疫苗,但 FDA 日前卻發佈嚴格的指引,拒絕在疫苗安全上妥協。
製藥商強生公司(Johnson & Johnson)受美國資助研發的疫苗 Ad26,近日有受試者報稱有不良反應,以致 Ⅲ 期臨床試驗於 10 月 12 日被迫叫停,美國數據與安全監控委員會(DSMB)正在調查不適原因。英國瑞典製藥商 AstraZeneca 與牛津大學合研疫苗 ChAdOx1,上月亦有受試者出現橫貫性脊髓炎,雖然多國已經重啟試驗,但 FDA 仍然中止美國的測試,務求作出徹底調查。
相比之下,中俄兩國未待臨床試驗完成,已急不及待授權使用個別研發中的疫苗。普京前日便倉卒宣佈,授權使用尚未開始 Ⅲ 期臨床試驗的疫苗 EpiVacCorona,先前完成的 Ⅰ/Ⅱ 期混合臨床試驗結果亦未有公開。
這些提早得到授權的疫苗,不但用在中俄兩國,還會開展「疫苗外交」。目前俄羅斯正與巴西、墨西哥和印度談判,對外供應尚未通過 Ⅲ 期臨床試驗的疫苗 Sputnik V;中國國企中國醫藥集團(Sinopharm)參與研發的兩款疫苗,未完成 Ⅲ 期臨床試驗,子公司已對外宣稱獲政府授權為數十萬人接種,又得到阿聯酋政府批准供醫護使用,衛生部長甚至親身接種,而印尼亦與中國簽訂協議,從中國進口 4,000 萬劑疫苗。
研發進度領先的武肺疫苗
- 研發國家:中國
- 研發機構:康希諾生物、中國解放軍軍事科學院軍事醫學研究院
- 研發階段:Ⅲ 期臨床試驗/有限度授權使用
5 月和 7 月通過 Ⅰ 期與 Ⅱ 期臨床試驗,軍方於 6 月 25 日核准疫苗為「特殊需要藥物」,為期一年,未知是否強制軍人注射。疫苗於 8 月才開始 Ⅲ 期臨床試驗,受試者來自沙特阿拉伯、巴基斯坦、俄羅斯等國。
- 研發國家:中國
- 研發機構:科興生物
- 研發階段:Ⅲ 期臨床試驗/有限度授權使用
在 Ⅰ/Ⅱ 期混合試驗報告中,沒有嚴重不良反應紀錄,Ⅲ 期試驗於巴西、印尼及土耳其進行。據報疫苗於 7 月獲緊急授權有限度接種,科興生物又與印尼簽訂協議,明年 3 月為印尼供應最少 4,000 萬劑疫苗,並揚言計劃明年初向全球供應。
- 研發國家:美國
- 研發機構:Moderna、美國國家衛生院
- 研發階段:Ⅲ 期臨床試驗
3 月進行首宗武肺疫苗臨床試驗,Ⅲ 期試驗於 7 月 27 日展開,受試者達 3 萬人,遍及美國 89 個地點,預料今年底至明年初方收集足夠數據,以驗證疫苗效力。Moderna 先後與美國和加拿大簽約,獲美國前後注資近 25 億美元。
- 研發國家:德國、美國、中國
- 研發機構:BioNTech、輝瑞(Pfizer)、復星醫藥
- 研發階段:Ⅱ/Ⅲ 期混合臨床試驗
5 月開始 Ⅰ/Ⅱ 期混合試驗兩款疫苗,7 月 27 日起於美國、阿根廷、巴西及德國進行 Ⅱ/Ⅲ 期混合臨床試驗,受試者有 3 萬人,中期報告錄得輕度至中度副作用,機構其後宣佈美國受試人數增至 4.3 萬人。美國就研發計劃注資 19 億美元,該公司已跟美國、日本及歐盟簽訂供貨協議。
- 研發國家:美國
- 研發機構:強生(Johnson & Johnson)、貝斯以色列女執事醫療中心(Beth Israel Deaconess Medical Center)
- 研發階段:Ⅲ 期臨床試驗(暫停)
建基於病毒 Ad26 所研發的武肺疫苗,3 月起獲美國注資 4.56 億美元,7 月開始 Ⅰ/Ⅱ 期混合臨床試驗後,9 月展開 Ⅲ 期試驗,受試者多達 6 萬人,先後與美國和歐盟簽訂供貨協議。10 月 12 日有受試者報稱身體不適,試驗目前叫停。
- 研發國家:英國、瑞典
- 研發機構:阿斯利康製藥(AstraZeneca)、牛津大學
- 研發階段:Ⅱ/Ⅲ 期混合臨床試驗(局部暫停)
建基於黑猩猩腺病毒 ChAdOx1 研發而成,Ⅰ/Ⅱ 期試驗未錄得任何副作用,Ⅱ/Ⅲ 期試驗於英國和印度進行,同時於巴西、南非和美國展開 Ⅲ 期臨床試驗,先後與歐盟及美國簽訂供貨協議。
9 月 6 日,有受試者出現橫貫性脊髓炎,測試被迫全球叫停,一星期後恢復試驗,但尚未通過 FDA 調查,在美國測試仍然暫停。
- 研發國家:美國
- 研發機構:Novavax
- 研發階段:Ⅲ 期臨床試驗
8 月於南非進行 Ⅱ 期臨床試驗,9 月於英國進行 Ⅲ 期試驗,受試者 1 萬人,10 月開始於美國展開更大規模測試,以明年初供貨為目標,Novavax 分別與美國和印度簽訂供貨協議。
- 研發國家:澳洲
- 研發機構:Murdoch Children’s Research Institute
- 研發階段:Ⅲ 期臨床試驗
屬 1900 年代初研發的肺結核疫苗,Murdoch Children’s Research Institute 正測試接種者是否對武肺病毒局部免疫。